sexta-feira, 25 de maio de 2012
Simulação 2: Escala de pH
Interagindo com esta simulação, você pode testar o pH de substâncias do cotidiano como o café, saliva e sabão para determinar se cada um é ácida, básica ou neutra. Visualize o número relativo de íons hidroxila e íons hidrogênio em solução. Alterne entre escalas logarítmica e linear. Investigue se alterar o volume ou a diluição com água afeta o pH. E você ainda pode criar seu próprio líquido! Divirta-se
Abraço
;~)
quarta-feira, 23 de maio de 2012
Ácidos e Bases: Aula Prática
O objetivo desta prática foi a identificação e classificação de substâncias ácidas e básicas do nosso cotidiano. Utilizando os indicadores químicos "Azul de Bromotimol" e "Fenolftaleína", os alunos verificaram soluções de amoníaco, limão, creme dental, shampoo, condicionador, acetona, vinagre e bicarbonato de sódio, identificando-as como ácidas ou básicas pela mudança de cor do indicador.
Estimaram também o pH da solução comparando as cores das soluções com uma cartela padrão, e em seguida conferiram a estimativa usando um papel indicador universal.
Ácido, segundo Arrhenius (1887), é toda substância que libera, em solução aquosa, íons H+. Base (também chamada de álcali) é qualquer substância que libera o ânion OH– (íons hidroxila).

Ácidos reagem com bases produzindo água e um sal. Reações deste tipo são conhecidas como Reações de Neutralização (vídeo). Para aumentar a curiosidade e o interesse dos alunos, a reação escolhida foi a formação de ácido carbônico e cloreto de cálcio pela adição de ácido clorídrico ao carbonato de cálcio presente na casca do ovo:
CaCO3 + 2 HCl → CaCl2 + H2CO3
Esta reação não segue rigorosamente a regra que acabamos de ver, mas também é considerada uma neutralização, pois o sal reagente (CaCO3) tem características alcalinas, uma vez que aumenta o pH da solução aquosa.
A espuma é resultado da liberação de CO2 proveniente da decomposição do H2CO3 (ácido carbônico).
H2CO3(aq) → H2O + CO2(g)

Abraços
;~)
sexta-feira, 11 de maio de 2012
Combustão: Triangulo do Fogo
Como prometido, segue a explicação sobre a última aula com os 1ºs anos sobre Combustão.
A combustão consiste na reação química entre dois reagentes (combustível e comburente) com grande liberação de energia na forma de calor.
Triângulo do Fogo
Assim, todas as reações de combustão são extremamente exotérmicas (ainda que necessitem de uma fonte de ignição). Várias substâncias podem ser usadas como combustível. Entre as sólidas incluem-se o carvão, a madeira e a turfa. Entre os líquidos usados como combustível encontramos os de origem vegetal ou animal, como o álcool, os óleos vegetais e gorduras, e os fósseis óleo diesel, o querosene e a gasolina.
Entre os combustíveis gasosos estão o gás natural ou os GLP (Gases Liquefeitos de Petróleo), representados pelo Propano e o Butano. As gasolinas e até os gases são utilizados para os motores de combustão interna.
Exemplo: combustão do metano
CH4 + 2 O2 → CO2 + 2 H2O + calor
A combustão permeia quase todos os setores de uma sociedade, em qualquer parte do mundo, independente do grau de desenvolvimento da nação. O processo de combustão é responsável por mais de 85% da energia utilizada pelo homem, sendo estratégico para a economia de todos os países. A queima de derivados do petróleo, gás natural, carvão mineral, lenha, carvão vegetal e dos resíduos agro-industriais corresponde a mais de 80% da energia utilizada no Brasil. Portanto, a combustão tem grande impacto nos setores industrial, de transporte e de geração de energia elétrica.
Abraço
;~)
quarta-feira, 9 de maio de 2012
Aula "Ácidos e Bases"
Hà! Aulinha sobre ácidos e bases. Não esqueçam que na próxima semana faremos uma aula prática sobre isso (se vocês levarem os itens solicitados, claro).
Ácidos
Ácidos são substâncias que ao entrar em contato com água sofrem ionização e produzem o íon positivo H+ e o íon negativo do outro elemento:

Bases
Pela teoria de Arrhenius, base, hidróxidos ou substâncias alcalinas (pois ocorrem com metais alcalinos) é toda substância que em água sofre dissociação e produz como íon negativo apenas OH- e torna o outro elemento um íon positivo. Exemplo:

Dessa forma concluímos que para uma substância ser considerada uma base de Arrhenius ela deve possuir em sua estrutura a hidroxila, isto é, o grupo OH-
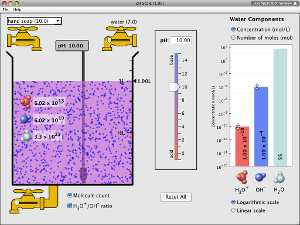
Escala de pH
O pH é uma medida da concentração de cátions de hidrogênio em solução aquosa. Os valores do pH variam em uma escala que vai de 0 a 14, sendo que a água pura tem pH próximo de 7, conforme a sua temperatura. Para soluções ácidas o pH é menor que 7, enquanto que para as soluções básicas o pH é maior que 7:
| pH | Tipo de solução |
|---|---|
| 0 - 6,99 | Ácido |
| 7 | Neutro |
| 7,01 - 14,0 | Básico |
Quanto mais próximo de 0 mais ácida é a substância, ou seja, a acidez decresce com o pH. Quanto mais próxima de 14 mais básica é a substância, isto é, a basicidade cresce com o pH.
Abraços
;~)
Aula: "Modelos Atômicos"
Essa vai especialmente pro pessoal do 2º. É um dos assuntos de química que eu mais gosto. Me fascina essa dinâmica natural (e ao mesmo tempo sobrenatural!) na qual estruturas tão pequenas (que sequer detectamos isoladamente: átomos) se juntam e se separam formando novas substâncias. Além disso, o estudo dos átomos é a essência da química. É sobre estas (e outras) teorias tão bem estruturadas e, ao mesmo tempo, sem comprovação cabal, que se sustenta a nossa ciência.
Fragmentos do Modelo Atômico de Dalton
Os modelos científicos existem para explicar e elucidar conceitos e fenômenos que não são evidentes aos nossos sentidos. Conceitos abstratos, portanto. Não podemos ver átomos isolados, assim, precisamos de modelos para explicá-los. O primeiro modelo atômico foi proposto por John Dalton em 1803. Apesar disso, a ideia de partículas elementares da matéria surgiu ainda no século V a.C., com o filósofo grego Leucipo de Mileto. Retomando estas ideias e à partir de suas experiências com gases ele idealizou suas hipóteses e postulados sobre os átomos.
Símbolos de Dalton para os átomos
O modelo de Dalton imperou por quase 100 anos! Só em 1897 experiências com o já conhecido tubo de raios catódicos permitiram que Joseph John Thomson elaborasse sua própria teoria atômica, evidenciando a existência de partículas carregadas negativamente e de dimensões muito menores do que o átomo: os elétrons. Seu modelo ficou conhecido como pudim de passas.
Tubo de raios catódicos
Pouco tempo depois, em 1911, os experimentos de Ernest Rutherford com partículas alfa emitidas pelo elemento Urânio demostraram que o modelo de Thomson precisava de ajustes.
Em um de seus experimentos, Rutherford atravessou uma fina folha de ouro com estas partículas, verificando que os átomos (neste caso, átomos de ouro) não eram maciços, e sim, repletos de espaços vazios (por onde passavam as partículas).
Experimento de Rutherford
Rutherford notou também que algumas partículas alfa (carregadas positivamente) eram desviadas ou ricocheteadas. A explicação para isso reside no fato de que o átomo não é apenas espaço vazio, mas possui um pequeno e denso núcleo positivo. Ernest Rutherford propôs então o modelo de átomo com movimentos planetários.

Abraços
;~)
terça-feira, 8 de maio de 2012
Explosão do Hidrogênio
Esta é uma das práticas que os meus alunos mais gostam. Tão legal que resolvi assumir os riscos de publicar aqui o passo-a-passo.
Nesta prática o alumínio (retirado de uma latinha de refrigerante)
reagiu com o hidróxido de sódio
se transformando em aluminato de sódio e gás hidrogênio. É uma reação exotérmica, libera calor:
2NaOH + 2Al --> 2NaAlO2 + H2
O gás foi recolhido em uma bexiga de borracha.

Em seguida, provocamos a combustão do gás, produzindo água:
2H2 + O2 --> 2H2O
Abraços
;~)
Assinar:
Postagens (Atom)